隨著中國經(jīng)濟發(fā)展,,越來越多的中國公司和投資人開始關(guān)注海外醫(yī)療器械市場和投資,。而美國作為擁有全世界最大醫(yī)療器械市場的國家,成為關(guān)注的焦點,。
首先,,美國有強大的消費力,2015年美國醫(yī)療器械市場占全球的40%,,約為1400億美元,。此外,美國也是醫(yī)療器械制造大國,,2015年出口額達430億美元,。其出色的消費和制造能力是吸引廣大投資者來美國投資項目的重要原因。
對于美國醫(yī)療器械投資,,本文闡述了投資者們需要知道的那些市場數(shù)據(jù)背后的故事,。
一,、美國醫(yī)療器械的創(chuàng)新環(huán)境
美國擁有世界上絕大多數(shù)頂尖醫(yī)療器械公司,像百特醫(yī)療(Baxter),,貝克曼庫爾特(Beckman Coulter),,碧迪醫(yī)療器械(Becton Dickinson,最近收購了以醫(yī)用導(dǎo)管聞名的巴德醫(yī)療,,C.R. Bard Inc.),,波士頓科學(xué)(Boston Scientific), 通用醫(yī)療集團(GE Healthcare Technologies), 強生醫(yī)療(Johnson & Johnson),美敦力(Medtronic),,史塞克公司(Stryker Corporation),,康德樂(Cardinal Health,最近從美敦力收購了柯惠醫(yī)療,,Covidien,,的部分業(yè)務(wù))等。
這些大公司,,不僅雇用了各種研發(fā)人才,,也在孜孜不倦地支持著大眾創(chuàng)新。
二,、強生的孵化器項目
強生孵化器項目借助強生公司現(xiàn)有的資源,,為創(chuàng)業(yè)者和公司提供了一個更有效、更靈活的創(chuàng)業(yè)平臺,,加速新技術(shù)的商業(yè)化,。每個進駐JLABS的創(chuàng)業(yè)公司,都可以享受強生公司從產(chǎn)品設(shè)計,、法規(guī)咨詢,,到資金和生產(chǎn)等各方面幫助。
這種多方位支持,,相比于傳統(tǒng)的天使投資或者風(fēng)投,,對很多初創(chuàng)公司更有吸引力。至今,,已有312家優(yōu)秀的創(chuàng)業(yè)公司入駐,。其中有121名創(chuàng)業(yè)者曾是強生員工,,JLABS吸納了這些有創(chuàng)意的前員工,,為他們提供創(chuàng)業(yè)的環(huán)境和指導(dǎo),同時又將這些項目牢牢抓在自己手里,,這確實是一個高招,。

JLABS
三、高校的孵化療器項目
除了頂尖的醫(yī)療器械公司,,美國的高校在創(chuàng)新上也毫不示弱,。一方面與大公司合作輸送人才,,一方面也開啟自己的孵化器項目。
高校的孵化器項目為學(xué)校里教職工和學(xué)生提供了積極友善的創(chuàng)業(yè)環(huán)境,。波士頓和加州地區(qū)是美國著名的兩個醫(yī)療器械集聚區(qū),,那里有一流高校,也云集了多所醫(yī)療器械公司和知名醫(yī)學(xué)院,。
醫(yī)療器械產(chǎn)業(yè)第二發(fā)達地區(qū)就是明尼蘇達州雙子城,,她擁有全世界最大的醫(yī)療器械公司,美敦力,。此外,,波士頓科學(xué),捷邁邦美(Zimmer Biomet),,圣猶太醫(yī)療(St. Jude Medical)等公司也都在此設(shè)有分部,。這里的明尼蘇達大學(xué),專門成立了醫(yī)療器械研發(fā)中心(Earl E. Bakken Medical Devices Center)來支持創(chuàng)新項目,;研發(fā)中心的項目跟明尼蘇達大學(xué)的科研緊密相連,,大學(xué)里豐厚的科研資金,也源源不斷地為醫(yī)療器械研發(fā)中心提供新的創(chuàng)意,。

明尼蘇達大學(xué)
更可貴的是,,在距離雙子城一個半小時車程的羅切斯特城,有全世界聞名的梅奧醫(yī)學(xué)中心(Mayo Clinic,,全美排名第一的醫(yī)院),;明尼蘇達大學(xué)與梅奧醫(yī)學(xué)中心長期開展醫(yī)學(xué)交流與合作。公司,,高校和頂尖醫(yī)院的結(jié)合,,為醫(yī)療器械的創(chuàng)新提供了完美的環(huán)境,也是創(chuàng)新器械出現(xiàn)的基礎(chǔ),。

梅奧醫(yī)學(xué)中心
在美國的中西部還有一個正在逐漸崛起的醫(yī)療器械創(chuàng)新城市,,猶他州的鹽湖城。
器械行業(yè)內(nèi)比較熟悉的是這里的尼爾森實驗室(Nelson Lab于2016年被施潔醫(yī)療技術(shù)Sterigenics收購),。尼爾森實驗室有能力依照各項國際(ISO)和美國標準(ASTM,,AAMI等),以及美國藥監(jiān)局(FDA)的GLP要求,,完成醫(yī)療器械的專項測試,。這些測試結(jié)果被用于器械的法規(guī)注冊和產(chǎn)品聲明。尼爾森在提供測試的同時,,也提供非常專業(yè)的咨詢服務(wù),。

尼爾森實驗室
鹽湖城沒有特別大的醫(yī)療器械公司,但這里遍地是小規(guī)模的醫(yī)療器械創(chuàng)業(yè)公司,以開發(fā)和生產(chǎn)一次性器械為主,。同時,,這里也聚集了非常活躍的天使投資人,。我跟這里很多創(chuàng)業(yè)公司和創(chuàng)業(yè)人合作過,,幫助他們開發(fā)和生產(chǎn)醫(yī)療器械。隨著合作的深入,,會逐漸提供設(shè)計咨詢,、法規(guī)咨詢等。

四,、美國醫(yī)療器械創(chuàng)新和創(chuàng)業(yè)的特點
創(chuàng)新,,可以是一個從無到有的過程,也可以是一個改良和進步的過程,。在我看來,,美國醫(yī)療器械的創(chuàng)新,大致可以分為這么幾類,。
革新型創(chuàng)新器械
革新型創(chuàng)新器械是在功能上有突破性創(chuàng)新的醫(yī)療器械,。比如目前越來越熱的手術(shù)機器人,其中最著名的要屬Intuitive surgical公司開發(fā)的達芬奇手術(shù)機器人,。手術(shù)機器人通常用在微創(chuàng)手術(shù)中,,可以大幅提高手術(shù)中器械操作的靈活性,幫助醫(yī)生在狹小空間完成復(fù)雜動作,,降低醫(yī)生的操作失誤,,同時為完成更復(fù)雜的手術(shù)提供可能。
有些復(fù)雜的手術(shù),,比如胸外科手術(shù),,由于對手術(shù)區(qū)域可視化的要求,采用傳統(tǒng)的器械,,很難在微創(chuàng)(1~2cm)的條件下完成手術(shù),。傳統(tǒng)的方法是心內(nèi)直視手術(shù),來保證醫(yī)生有一個清晰的視野,。但達芬奇手術(shù)機器人有高精度的攝像頭和精密控制的機械手,,能輕松完成微創(chuàng)條件下的復(fù)雜手術(shù)。
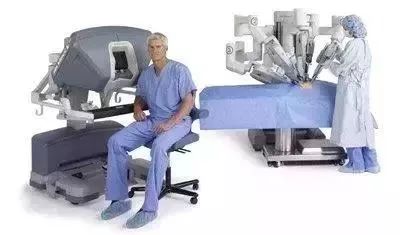
達芬奇手術(shù)機器人
這類創(chuàng)新器械占的比例往往比較小,。他們對產(chǎn)品的設(shè)計和制造有非常高的要求,,同時對FDA的審批人員也是一個挑戰(zhàn)。由于FDA之前沒有接觸到過類似的器械,,他們的批準過程其實變成了FDA自己一個學(xué)習(xí)和研究的過程,。對企業(yè)來講,結(jié)果就是更嚴格的要求和更長的審批時間,。
改良型創(chuàng)新器械
大部分醫(yī)療器械在投入市場的時候,,都不是盡善盡美的。醫(yī)學(xué)是一門系統(tǒng)性科學(xué),,在治療中有太多的因素需要考慮,。即使是FDA在評估新器械的時候,也只是要求器械的效率大于風(fēng)險(benefit over risk),。這就給醫(yī)療器械持續(xù)的創(chuàng)新提供了條件,。
一個很好的例子就是3D打印技術(shù)和新材料技術(shù)在植入物上的應(yīng)用。3D打印為制造個性化假體提供了可能,。個性化的假體較比傳統(tǒng)的批量生產(chǎn)假體,,有更多的優(yōu)勢。它們獲得病人生物數(shù)據(jù),,生成貼合病人生物學(xué)和力學(xué)結(jié)構(gòu)的假體,,縮短了實際手術(shù)時間,也避免了植入假體跟傷口不匹配的可能,。

FDA在2013年批準了第一個3D打印的植入物,,即OPM公司的3D打印聚合物顱骨假體,。在2017年,另外一個美國公司SI-BONE的3D打印鈦金屬假體獲得FDA批準,。從聚合物到金屬的3D打印,是一個巨大的飛躍,,因為金屬假體對材料的力學(xué)性能要求更高,。
考慮到目前3D打印受材料的局限性仍然很大,新材料在這一類醫(yī)療器械方向的發(fā)展會有很大空間,。將來新材料的崛起,,比如可吸收材料,亦或力學(xué)性能與人體更接近的材料,,還有減少免疫排斥的材料等,,都將對3D打印假體的市場產(chǎn)生巨大的影響。
還有一種常見的改良器械是對醫(yī)院成本的優(yōu)化,。近期,,在Biotochina路演上展示了一款由EDGe Surgical推出的一次性數(shù)字深度計。根據(jù)其預(yù)期用途,,這一個新器械能代替目前脊柱融合手術(shù)中使用的7個器械,。即使EDGe Surgical向美國醫(yī)院收取原來7個器械加起來一半的價格來銷售這一個新器械,也將為醫(yī)院節(jié)省50%的成本,,醫(yī)院會更容易接受這個變更,。

EDGe Surgical的一次性數(shù)字深度計
合規(guī)型創(chuàng)新器械
法規(guī)在美國是一個不得不考慮的方面。我們經(jīng)常會聽說美國醫(yī)療領(lǐng)域中的巨額賠償案例。例如2014年,,紐約市急救中心的救護車上,,由于沒有裝備先進的生命維持設(shè)備導(dǎo)致一名12歲患者嚴重的腦部損傷以致癱瘓,法院判決急救中心賠償患者1.72億美元,。再如2007年,,佛羅里達坦帕市醫(yī)院的醫(yī)務(wù)人員,由于對病人術(shù)后的感染控制不當,,導(dǎo)致該病人失去所有手指和雙腿的大部分,,醫(yī)院被勒令賠償患者3千萬美元。

嚴格的法規(guī)要求和巨額的賠償,,促生了美國一大批防護性的醫(yī)療器械,。特別是在感染防護(infection control),銳器傷害(sharps injury)等方面,。美國疾病防控中心(CDC)在2009年發(fā)布統(tǒng)計,,每年全美醫(yī)院因為病人在醫(yī)院中發(fā)生感染而導(dǎo)致的直接醫(yī)療費用為350億至450億美元,這里不包括醫(yī)院和保險公司后期支付給病人的賠償,。
以此為商業(yè)契機,,很多公司研發(fā)相應(yīng)的器械,幫助醫(yī)院改進環(huán)境,,控制感染,。例如Ivera Medical Corp(在2015年被3M公司以約1.53億美元收購),設(shè)計了一款用在滯留導(dǎo)管和輸液管上的防感染保護帽(Curos disinfecting port protectors),。當病人在輸完液后,,護士就會為滯留在病人身上的導(dǎo)管蓋上這個一次性的保護帽(保護帽本身是滅菌的,內(nèi)部還自帶酒精消毒),,防止病人在活動時環(huán)境對導(dǎo)管的污染,。

可以看出,美國不光有先進的技術(shù)和創(chuàng)新,,社會制度和環(huán)境特點也反映到了其醫(yī)療器械的創(chuàng)新上,。我們經(jīng)常說醫(yī)療器械的設(shè)計不同于一般的消費品,需要考慮到醫(yī)生,、護士,、病人等多方面用戶。同時,,醫(yī)療器械的支付也不同于一般的消費品,,很多時候使用者(醫(yī)生或者病人)并不是醫(yī)療器械的實際支付者(常常由保險來支付,也可能是醫(yī)院來支付),。這些都是我們在評估一個創(chuàng)新醫(yī)療器械的時候需要考慮的,。

五,、美國醫(yī)療器械創(chuàng)業(yè)公司的特點
美國醫(yī)療器械的創(chuàng)業(yè)公司,跟很多其他創(chuàng)業(yè)公司一樣,,往往開始的時候只有幾個人,。他們有獨特的想法,設(shè)計了一款醫(yī)療器械,,并完成了專利的注冊,。如果是一款消費類產(chǎn)品,,那么接下來,,在拿到足夠的資本后,就可以生產(chǎn)和銷售了,。
但是醫(yī)療器械不一樣,,因為在法規(guī)上,它受到美國FDA(U.S. Food and Drug Administration)的監(jiān)管,;在銷售上,,很多醫(yī)院和診所都組織或者加入了GPO(Group Purchasing Organization),通過整合器械的使用量,,跟器械商談判,,來獲得有利的采購價格。
不同于中國藥監(jiān)局(CFDA),,我認為美國FDA的法規(guī)對創(chuàng)新公司更為有利,。作為一個初創(chuàng)公司,幾乎不可能有自己的工廠來生產(chǎn)產(chǎn)品,。在消費領(lǐng)域,,最常見的做法是創(chuàng)業(yè)公司把產(chǎn)品外包給第三方公司做代加工。

美國FDA也接受這個概念,。只要產(chǎn)品設(shè)計公司(這個情況下即創(chuàng)業(yè)公司)和代加工公司均在FDA注冊(備案),,依照FDA的法規(guī)完成產(chǎn)品設(shè)計和生產(chǎn)即可。在這種情況下,,創(chuàng)業(yè)公司負責(zé)醫(yī)療器械在FDA的法規(guī)注冊,,從而擁有產(chǎn)品在FDA的注冊權(quán),并可以隨時更換代工廠商,。
但在目前CFDA的法規(guī)下,,這一操作是不合規(guī)的。CFDA要求醫(yī)療器械的注冊商和制造商必須是同一家,,而且目前實行的是審批制,。這是目前一個影響國內(nèi)醫(yī)療器械創(chuàng)新的地方。
除了設(shè)計和生產(chǎn),,醫(yī)療器械創(chuàng)業(yè)公司還少不了法規(guī)人員和銷售人員,。
經(jīng)過多年的發(fā)展,,美國出現(xiàn)一大批合同制的法規(guī)人員和銷售人員(美國公司正式員工的雇用不存在合同,叫做at-will employment,;只有臨時工或者短期工才是合同制,,不享有公司福利。這與中國的勞工機制不同),。
對于新器械的開發(fā)和注冊(如果不是三類器械),,法規(guī)人員的參與是有限的。這些負責(zé)法規(guī)的人,,往往以合同工或者咨詢(contractor/consultant)的方式,,幫助創(chuàng)業(yè)公司完成新器械的FDA注冊,并在需要時提供相應(yīng)的法規(guī)咨詢,。
器械的銷售人員也類似,,他們跟附近的醫(yī)院和診所非常熟悉,為各個醫(yī)療器械公司提供銷售服務(wù),,賺取傭金,。這些人員我稱之為基礎(chǔ)設(shè)施,他們的普遍存在,,很大程度上縮短了器械創(chuàng)新和上市的周期,。

六、美國創(chuàng)新器械進入中國市場的討論
前面我們說到,,美國是目前全世界醫(yī)療器械消費最大的市場,,而中國,則是醫(yī)療器械市場發(fā)展最快的國家,。
2016年,,中國醫(yī)療器械市場規(guī)模約為540億美元,占全球15%,,較2015年增長20.1%,,其中72.7%的增長來自醫(yī)院的采購。
隨著人們生活水平逐步提高,,城鄉(xiāng)化差距的縮小,,以及老齡化的加速,中國對醫(yī)療技術(shù)和產(chǎn)品的追求會不斷提高,。包括最近愈演愈烈的赴美就醫(yī),,赴日就醫(yī),都是國內(nèi)日益增長的醫(yī)療需求得不到滿足的表現(xiàn),。
同時,,我們知道全球第七大醫(yī)療公司康德樂在2017年11月正式出售了其在中國的全部醫(yī)藥業(yè)務(wù),但仍然保留了在華醫(yī)療器械業(yè)務(wù),??梢钥闯鰢H公司對中國醫(yī)療器械行業(yè)發(fā)展的看好,。
將美國創(chuàng)新醫(yī)療器械引入中國的時候,除了準確預(yù)估市場大小,,還需要從以下幾個方面考慮,。
1. 支付方式
醫(yī)療器械很多時候不是由用戶(患者)來直接支付的,涉及到保險公司,、醫(yī)院等等,。即使用戶的需求在,但如果中美的支付方式不一樣,,最后形成的市場大小也會有差異,。

2.法規(guī)評估
除了前面提到的,CFDA對國產(chǎn)器械注冊商和制造商的捆綁要求之外,,當國外最新技術(shù)進入中國市場時,,需要考慮CFDA對新技術(shù)的接受程度,。
從歷史經(jīng)驗來看,,CFDA無論從法規(guī)要求的制定還是對新器械的批準,都或多或少在效仿和跟隨FDA的步伐,。在對新技術(shù)和器械的批準上,,很難超越FDA。即使FDA已經(jīng)批準了的器械,,如果技術(shù)上是超前的,,CFDA也需要一段時間來理解和適應(yīng)。這就會影響產(chǎn)品上市的時間,。

3.市場接受
前面提到,,美國由于其縝密的法規(guī)要求和巨額的懲罰性賠償,造就了一些市場特有的醫(yī)療器械,。這些器械,,在其他市場并不一定適用。
一個很好的例子是,,美國普遍使用的一次性器械的概念,。從各式各樣的一次性無菌器械,到各大醫(yī)院手術(shù)室使用的個性化手術(shù)包概念,,杜絕了器械由于重復(fù)滅菌使用帶來的感染和器械性能下降的風(fēng)險,。
相比較,中國手術(shù)室目前較多還在用重復(fù)使用的器械,。因為重復(fù)滅菌的成本和其他風(fēng)險成本不足以讓中國醫(yī)院去接受一次性器械的價格,。
